Формула красного фосфора
Определение и формула красного фосфора
Цвет определяется способом получения и степенью дробления вещества. Имеет металлический блеск. При нагревании возгоняется. Окисляется на воздухе. Не растворяется в воде и сероуглерода. Химическая активность красного фосфора значительно меньше, чем белого и черного. Растворяется в расплаве свинца, из которого кристаллизуется фиолетовый фосфор (фосфор Гитторфа).

Рис. 1. Красный фосфор. Внешний вид.
Химическая формула красного фосфора
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой.
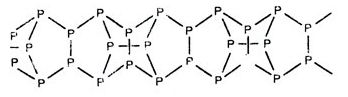
Графическая (структурная) формула красного фосфора
Структурная (графическая) формула полимера красного фосфора является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Электронная формула
Электронная формула, показывающая распределение электронов в атоме по энергетическим подуровням показана ниже:
15P 1s22s22p63s23p3
Она также показывает, что фосфор относится к элементам р-семейства, а также число валентных электронов — на внешнем энергетическом уровне находится 5 электронов (3s23p3).
Примеры решения задач
| Задание | Два углеводорода имеют разные относительные молекулярные массы: 26 и 78, но одинаковый состав: 92,3% углерода и 7,7% водорода. Найдите молекулярные формулы углеводородов. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Обозначим количество моль элементов, входящих в состав соединения за «х» (углерод) и «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = ω(C)/Ar(C) : ω(H)/Ar(H); x:y= 92,3/12 : 7,7/1; x:y= 7,69 : 7,7 = 1 : 1 Значит простейшая формула углеводорода имеет вид CH и молярную массу 13 г/моль [M(CH) = Ar(C) + Ar(H) = 12 +1 = 13 г/моль]. Чтобы найти истинную формулу соединения найдем отношение его молярных масс: Msubstance(1) / M(CH) = 26 / 13 = 2 Значит индексы атомов углерода и водорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид C2H2. Это ацетилен. Msubstance(2) / M(CH) = 78 / 13 = 6 Значит индексы атомов углерода и водорода должны быть в 6 раза выше, т.е. формула вещества будет иметь вид C6H6. Это бензол. |
| Ответ | C2H2 и C6H6 |
| Задание | Составьте формулу соединения натрия, фосфора и кислорода, если массовые доли элементов в нём: ω(Na) = 34,6%, ω(P) = 23,3%, ω(O) = 42,1%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Обозначим количество моль элементов, входящих в состав соединения за «х» (натрий), «у» (фосфор), «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y:z = ω(Na)/Ar(Na) : ω(P)/Ar(P) : ω(O)/Ar(O); x:y:z= 34,6/23 : 23,3/31: 42,1/16; x:y:z= 1,5 : 0,75: 2,63 = 2 : 1 : 3 Значит формула соединения натрия, фосфора и кислорода будет иметь вид Na2PO3. |
| Ответ | Na2PO3 |











