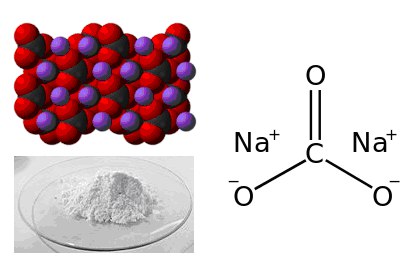
Формула карбоната натрия
Определение и формула карбоната натрия
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Сода (гидрат), сода кальцинированная, или стиральная (безводный).
Физические свойства – белый, плавится без разложения, при дальнейшем нагревании разлагается.
Хорошо растворяется в воде (сильный гидролиз по аниону), создает сильнощелочную среду:
![]()
![]()
Химические свойства карбоната натрия
- Реагирует с кислотами:
![Rendered by QuickLaTeX.com \[ Na_2CO_3+2HCl=2NaCl+CO_2 \uparrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9610ebd3778031d52ea9a1f82a155d6d_l3.png)
- Взаимодействует с основаниями:
![Rendered by QuickLaTeX.com \[ Na_2CO_3+Ba\left ( OH \right )_2=BaCO_3 \downarrow + 2NaOH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a51b5344f5a6370e2b57117a23fa6556_l3.png)
- Вступает в химическое взаимодействие с углеродом (кокс) при высокой температуре:
![Rendered by QuickLaTeX.com \[ Na_2CO_3+2C=2Na+3CO \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e9175d93e6dcfcd7f089181f822d08a0_l3.png)
- Вступает в реакцию с
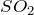 с образованием сульфита натрия:
с образованием сульфита натрия:
![Rendered by QuickLaTeX.com \[ Na_2CO_3+SO_2=Na_2SO_3+CO_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6c2b4843b9827806a216af949eebea8d_l3.png)
- При прокаливании
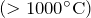 разлагается:
разлагается:
![Rendered by QuickLaTeX.com \[ Na_2CO_3=Na_2O+CO_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e5b51bbda436a3f2287cc46ee8d820ca_l3.png)
Получение
Карбонат натрия можно получать взаимодействием гидроксида натрия и углекислого газа:
![]()
Также можно привести способ получения из гидрокарбоната натрия при его нагревании до ![]() :
:
![]()
Применение
Карбонат натрия находит широкое применение в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; применяется для уменьшения жёсткости воды. Карбонат натрия — исходный реагент для получения гидроксида натрия. Также он используется в качестве пищевой добавки (разрыхлитель).
Примеры решения задач
| Задание | Рассчитайте массу карбоната натрия, необходимую для приготовления |
| Решение | Из справочника находим, что при Рассчитаем массу раствора:
Найдем массу карбоната натрия через его массовую долю в растворе: Тогда, |
| Ответ |
| Задание | Какую массу карбоната натрия необходимо взять для получения |
| Решение | Из уравнения состояния идеального газа рассчитаем количество моль углекислого газа.
Стандартные условия — это Из справочника возьмем Рассчитаем количество моль
Из Найдем массу карбоната натрия: |
| Ответ |











