Формула карбоната аммония
Определение и формула карбоната аммония
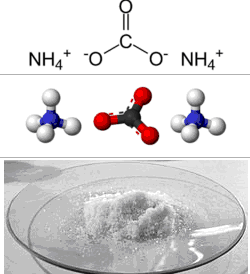
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белые кристаллы, хорошо растворимые в воде.
Карбонат аммония – соль, гидролизующаяся и по катиону и по аниону. Реакция раствора слабо щелочная так как гидроксид аммония более сильный электролит чем угольная кислота. Суммарное уравнение гидролиза выглядит как:
![]()
При хранении спонтанно разлагается уже при комнатной температуре, в растворе более устойчив к нагреванию. Разложение протекает по уравнению:
![]()
Химические свойства карбоната аммония
- Карбонат аммония при нагревании разлагается на углекислый газ, воду и аммиак:
![Rendered by QuickLaTeX.com \[ \left(NH_4\right)_2CO_3\rightarrow CO_2+H_2O+2NH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d1038dfd7c598afc078963a4ba1474db_l3.png)
- Данное соединение вступает в реакции обмена с кислотами, щелочами, а также солями:
![Rendered by QuickLaTeX.com \[ \left(NH_4\right)_2CO_3 +2HCl\rightarrow 2NH_4Cl+CO_2+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-65c34a5560f075789bf15ee3ae809df2_l3.png)
![Rendered by QuickLaTeX.com \[ \left(NH_4\right)_2CO_3 +2NaOH\rightarrow 2Na_2CO_3+2NH_4OH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ce96be0f2bef41f5cdba85865f5eea82_l3.png)
![Rendered by QuickLaTeX.com \[ \left(NH_4\right)_2CO_3 +CaCl_2\rightarrow CaCO_3\downarrow+2NH_4Cl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-815f21337674673d91d1920325701cb1_l3.png)
Получение карбоната аммония основывается на реакции концентрированного водного раствора аммиака с углекислым газом:
![]()
Применение
Карбонат аммония находит свое применение в качестве заменителя дрожжей в хлебопечении и кондитерской промышленности (пищевая добавка Е503. Также он применяется для получения сульфата аммония из гипса; в лекарственных средствах; в косметической промышленности в качестве красителя и др.
Примеры решения задач
| Задание | Сколько литров аммиака можно получить из |
| Решение | Запишем химическую реакцию разложения карбоната аммония при нагревании:
Определим количество моль где Из стехиометрии реакции следует, что Вычислим объем аммиака по уравнению состояния идеального газа: Выразим из уравнения объем и подставим числовые значения: |
| Ответ | Объем аммиака равен |
| Задание | Определить направление химической реакции при |
| Решение | Запишем исследуемую химическую реакцию:
При постоянной температуре и давлении направление химической реакции показывает изменение энергии Гиббса реакции где где Из справочных данных: Подставим численные данные в выражение для нахождения изменения энтальпии: Подставим численные данные в выражение для нахождения изменения энтропии: Найдем изменение энергии Гиббса: |
| Ответ | Реакция в данных условиях не может протекать в прямом направлении. |











