Формула гидрокарбоната натрия
Определение и формула гидрокарбоната натрия
В обычных условиях гидрокарбонат натрия – это твердое вещество белого цвета (рис. 1), разлагающееся при слабом нагревании. Во влажном состоянии начинает разлагаться при комнатной температуре. Умеренно растворяется в воде (гидролизуется по аниону). Кристаллогидратов не образует.

Рис. 1. Гидрокарбонат натрия. Внешний вид.
Химическая формула гидрокарбоната натрия
Химическая формула гидрокарбоната натрия NaHCO3. Она показывает, что в состав данной молекулы входят один атом натрия (Ar = 23 а.е.м.), один атом водорода (Ar = 1 а.е.м.), один атом углерода (Ar = 12 а.е.м.) и три атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу гидрокарбоната натрия:
Mr(NaHCO3) = Ar(Na) + Ar(H) + Ar(C) + 3×Ar(O);
Mr(NaHCO3) = 23 + 1 + 12+ 3×16= 44 + 48 = 92
Графическая (структурная) формула гидрокарбоната натрия
Структурная (графическая) формула гидрокарбоната натрия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
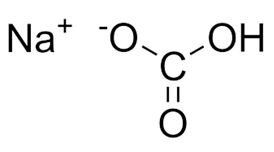
Ионная формула
Гидрокарбонат натрия представляет собой кислую соль угольной кислоты, которая подвергается диссоциации в водном растворе согласно следующему уравнению реакции:
NaHCO3 ↔ Na+ + HCO3—
Примеры решения задач
| Задание | Массовая доля хлора в хлориде фосфора составляет 77,5%. Определите простейшую формулу соединения. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Вычислим массовую долю фосфора в соединении: ω (P) = 100% — ω(Cl) = 100% — 77,5% = 22,5% Обозначим количество моль элементов, входящих в состав соединения за «х» (фосфор) и «у» (хлор). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = ω(P)/Ar(P) : ω(Cl)/Ar(Cl); x:y= 22,5/31 : 77,5/35,5; x:y= 0,726 : 2,183 = 1 : 3 Значит формула соединения фосфора с хлором будет иметь вид PCl3. Это хлорид фосфора (III). |
| Ответ | PCl3 |
| Задание | Образец соединения фосфора и брома массой 81,3 г содержит 0,3 моль фосфора. Найдите эмпирическую формулу соединения. |
| Решение | Рассчитаем массу фосфора в соединении (относительная атомная масса равна 31 а.е.м. и численно совпадает со значениями молекулярной и молярной масс):
m(P) = n(P) × M(P); m(P) = 0,3 × 31 = 9,3 г Определим массу брома в составе соединения: m(Br) = msubstance – m(P); m(Br) = 81,3 – 9,3 = 72 г Обозначим количество моль элементов, входящих в состав соединения за «х» (фосфор) и «у» (бром). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = m(P)/Ar(P) : m(Br)/Ar(Br); x:y= 9,3/31 : 72/80; x:y= 0,3 : 0,9 = 1 : 3 Значит формула соединения фосфора и брома будет иметь вид PBr3. |
| Ответ | PBr3 |











