Формула гелия
Определение и формула гелия
По физическим свойствам гелий наиболее близок к молекулярному водороду. Вследствие ничтожной поляризуемости атомов гелия у него самые низкие температуры кипения (-269oC) и плавления (-271oC при 2,5×106 Па).
Гелий по сравнению с другими элементами обладает наибольшей энергией ионизации атома (24,59 эВ). Особая устойчивость электронной структуры атома отличает гелий от остальных элементов Периодической системы Д.И. Менделеева.
Гелий хуже других газов растворяется в воде и других растворителях. В 1 л воды, например, растворяется при 0oC менее 10 мл гелия, т.е. в два с лишним раза меньше, чем молекул водорода (H2), и в 51000 раз меньше, чем молекул хлороводорода (HCl).
Химическая формула гелия
Химическое обозначение гелия – He от латинского слова «helium». Этот химический элемент расположен в первом периоде в VIIIA группе Его внешний энергетический уровень заполнен, из-за чего он наименее химически активен, чем другие химические элементы (входит в группу элементов под названием инертные газы). Относительная атомная масса гелия равна 4,0026 а.е.м.
Электронная формула гелия
Ядро атома гелия содержит два протона и два нейтрона (массовое число гелия равно 4-м). Как и в атоме водорода, у гелия есть всего один энергетический уровень, на котором находятся два электрона (рис. 1).
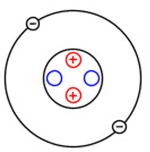
Рис. 1. Строение атома гелия.
Электронная формула атома гелия в основном состоянии выглядит следующим образом:
1s2
Примеры решения задач
| Задание | При сжигании 6,5 г газообразного органического соединения получено 11,2 л (н.у.) углекислого газа и 4,5 г воды. Относительная плотность этого соединения по водороду равна 13. Выведите его химическую формулу. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz →CO2 + H2O Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(CO2) = [V(CO2) / Vm]×M(CO2); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×n(H2O) / M(H2O)]×M(H) Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль Тогда, m(C) = [11,2 / 22,4]×44 = 6 г; m(H) = [2×4,5 / 18] ×1 = 0,5 г m(O) = m(CxHyOz) – m(C) – m(H) = 6,5 – 6 – 0,5 = 0, что свидетельствует о том, что в составе данного органического вещества нет. Определим химическую формулу соединения как CxHy: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y =6/12 :0,5/1; x:y = 0,5 : 0,5 = 1: 1 Значит простейшая формула соединения CH и молярную массу 13 г/моль [M(CH) = Ar(C) + Ar(H)= 12 + 1 = 13 г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 13 = 26 г/моль Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH) = 26 / 13 = 2 Значит индексы атомов углерода и водорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид C2H2. Это ацетилен. |
| Ответ | C2H2 |
| Задание | В результате сгорания кислородсодержащего органического соединения в избытке воздуха собрано 1,584 г углекислого газа и 0,972 мл воды. Плотность пара этого соединения по воздуху равна 1,5865. Выведите химическую формулу соединения, если она содержит два одноименных радикала. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz+ Oz→CO2 + H2O Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]/M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); m(H) =[2×V(H2O)×M(H) / M(H2O)×1 (г/мл)] Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль Тогда, m(C) = [1,584 / 44]/12 = 0,432 г; m(H) = [2×0,971 ×1 / 18 ×1 (г/мл)] = 0,108 г Значение молярной массы органического вещества можно определить при помощи его плотности по воздуху: Msubstance = Mair × Dair; Msubstance = 29 × 1,5862 = 46 г/моль Найдем число атомов углерода и водорода в соединении: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y = 0,432/12 :0,108/1; x:y = 0,036 : 0,108 = 1: 3 Значит простейшая формула углеводородного радикала этого соединения имеет вид CH3и молярную массу 15 г/моль [M(CH) = Ar(C) + 3×Ar(H)= 12 + 3×1 = 12 + 3 = 15 г/моль]. Это означает, что на кислород приходится [46-15 = 31 г/моль], что невозможно. Учитывая условие задачи про два одноименных радикала 2×М(CH3) = 2×15 = 30 г/моль, получаем, что на кислород приходится [46-30 = 16 г/моль], т.е. органическое кислородсодержащее соединение имеет вид CH3-O-CH3. Это ацетон (диметилкетон). |
| Ответ | CH3-O-CH3 |











