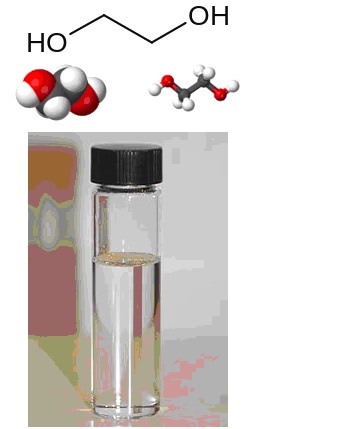
Формула этиленгликоля
Определение и формула этиленгликоля
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – это сиропообразная структура без цвета и запаха, сладкая на вкус.
По мнению большинства исторических источников, французский химик Вюрц первоначально получил этиленгликоль в 1856. Он обрабатывал йодистый этилен ![]() ацетатом серебра, а затем гидролизовал полученный «Этилен диацетат» гидроксидом калия. Вюрц назвал это новое соединение «гликоль», потому что ему присущи качества как этанола (с одной гидроксильной группой) так и и глицерина (с тремя гидроксильными группами).
ацетатом серебра, а затем гидролизовал полученный «Этилен диацетат» гидроксидом калия. Вюрц назвал это новое соединение «гликоль», потому что ему присущи качества как этанола (с одной гидроксильной группой) так и и глицерина (с тремя гидроксильными группами).
Химические свойства этиленгликоля
- Этиленгликоль реагирует с различными щелочными и щелочно-земельными металлами:
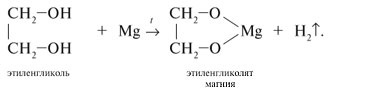
- В реакции с
 обменивают одну или несколько гидроксильных групп на атомы галогена:
обменивают одну или несколько гидроксильных групп на атомы галогена:
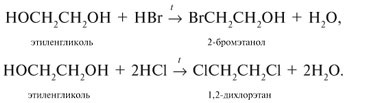
Получение
Этиленгликоль производят из этилена через промежуточное образование этиленоксида. Этиленоксид реагирует с водой с образованием этиленгликоля согласно химическому уравнению:
![]()
Качественная реакция
Качественной реакцией является взаимодействие спирта со свежеосажденным ![]() . Наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (II).
. Наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (II).
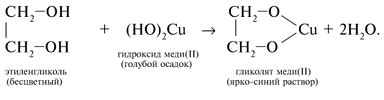
Применение
Этиленгликоль в основном используется в составе антифризов ![]() , а также в качестве сырья при производстве сложных полиэфиров, таких как полиэтилентерефталат (ПЭТ)
, а также в качестве сырья при производстве сложных полиэфиров, таких как полиэтилентерефталат (ПЭТ) ![]() .
.
Примеры решения задач
| Задание | Сколько щавелевой кислоты можно получить из 6,2 г этиленгликоля? |
| Решение | Рассмотрим химическую реакцию получения щавелевой кислоты из двухатомного спирта этиленгликоля:
Из стехиометрии следует, что |
| Ответ |
| Задание | Какова энтальпия испарения этиленгликоля, если давление его паров при |
| Решение | Вычислим среднюю энтальпию испарения в данном интервале температур по уравнению Клаузиуса-Клайперона:
|
| Ответ |






![Rendered by QuickLaTeX.com \[ \ln \frac{P_2}{P_1} = \frac{\Delta H \cdot (T_2 - T_1)}{R \cdot T_1 \cdot T_2} \Rightarrow \Delta H = \frac{R \cdot T_1 \cdot T_2 \cdot \ln \frac{P_2}{P_1}}{T_2 - T_1} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9143b44f52e38a1901ff0fab780a943f_l3.png)





