Формула этаналя
Определение и формула этаналя
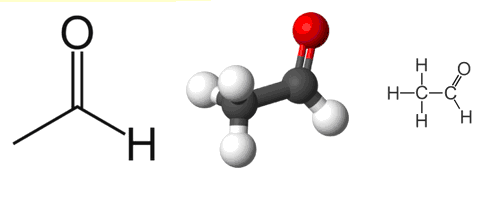
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – жидкость с резким неприятным запахом.
Хорошо растворяется в воде и в других органических растворителях.
Пары вещества ядовиты, раздражают слизистую оболочку, вызывают головную боль.
Химические свойства этаналя
- Для этаналя характерна реакция гидрирования, протекающая в присутствии никеля, кобальта. При этом получается этанол:
![Rendered by QuickLaTeX.com \[ CH_3COH + H_2 \rightarrow CH_3CH_2OH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bab10fae8a475fb57815b002037b683c_l3.png)
- Характерной реакцией нуклеофильного присоединения является взаимодействие с синильной кислотой:
![Rendered by QuickLaTeX.com \[ CH_3COH + HCN \rightarrow CH_3(CN)CH(OH) \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2dd527adf78c230045cf78b05f0a4189_l3.png)
- Реакция с аммиаком дает этанимин:
![Rendered by QuickLaTeX.com \[ CH_3COH + NH_3 \rightarrow CH_3-CH=NH + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c95c9498ccb7bf48a7020654f792b348_l3.png)
- Качественной является реакция серебряного зеркала:
![Rendered by QuickLaTeX.com \[ CH_3COH + 2[Ag(NH_3)_2]OH \rightarrow CH_3-COONH_4 + 3NH_3 + H_2O + 2Ag \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0974360edec558d68f1e7b8b494bafc6_l3.png)
Применение
Из этаналя в промышленных масштабах получают уксусную кислоту, уксусный ангидрид, этанол, бутанол и многие другие важные вещества.
Примеры решения задач
| Задание | Этаналь разлагается в газообразном виде следующим образом: |
| Решение | Согласно теории промежуточных соединений, объясняющей гомогенный катализ, реакция
Очевидно, что Поскольку скоростьлимитирующей стадией каталитического процесса является медленная стадия, то уравнение скорости разложения ацетальдегида согласно закону действующих масс будет |
| Ответ |
| Задание | К |
| Решение | Сначала находим массу ацетальдегида, содержащегося в исходном растворе:
Запишем уравнения реакции: Установим, какое из исходных веществ взято в избытке. По уравнению реакции: Ацетальдегид взят в избытке. |
| Ответ | Ацетальдегид взят в избытке. |











