Формула алкадиенов
Определение и формула алкадиенов
Химическая формула алкадиенов
Общая химическая формула алкадиенов CnH2n-2, например C3H4–пропадиен, C4H6 –бутадиен, C5H8 – пентадиен и т.д. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества:
Mr(C3H4) = 3×Ar(C) + 4×Ar(H);
Mr(C3H4) = 3×12 + 4×1 = 36 + 4 = 40
Mr(C4H6) = 4×Ar(C) +6×Ar(H);
Mr(C4H6) = 4×12 + 6×1 = 48 + 6 = 54
Mr(C5H8) = 5×Ar(C) +8×Ar(H);
Mr(C5H8) = 5×12 + 8×1 = 60 + 8 = 68
Графическая (структурная) формула алкадиенов
Структурная (графическая) формула алкадиенов является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы.
Рассмотрим, как выглядит графическая формула алкадиенов на примере простейшего представителя сопряженных диенов — бутадиена – 1, 3:
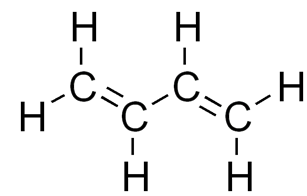
Рис. 1. Структурная формула бутадиена – 1,3.
Все четыре атома углерода в бутадиене – 1, 3 находятся в состоянии sp2— гибридизации. Они лежат в одной плоскости и составляют σ-скелет молекулы (рис. 2). Негибридизованные p-орбитали каждого атома углерода перпендикулярны плоскости σ-скелета и параллельны друг другу, что создает условия для их взаимного перекрывания. Перекрывание происходит не только между атомами С-1 – С-2 и С-3 – С-4, но и частично между атомами С-2 – С 3. При перекрывании четырех p-орбиталей происходит образование единого π — электронного облака, т.е. сопряжение двух двойных связей. Этот тип сопряжения называется π, π – сопряжением, так как взаимодействуют орбитали π-связей.
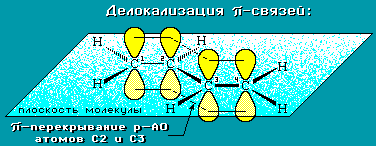
Рис. 1. Строение молекулы бутадиена – 1, 3.
В сопряженной системе π-электроны уже не принадлежат определенным связям, они делокализованы, т.е. электронная плотность распределена по всей сопряженной системе, по всем связям и атомам.
Примеры решения задач
| Задание | При полном сгорании кислородсодержащего органического вещества массой 13,8 г получили 26,4 г углекислого газа и 16,2 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 23. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz+ Oz→CO2 + H2O Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль Тогда, m(C) = [26,4 / 44]×12 = 7,2 г; m(H) = 2×16,2 / 18 ×1= 1,8 г m(O) = m(CxHyOz) – m(C) – m(H) = 13,8 – 7,2 – 1,8 = 4,8 г Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z= 7,2/12 :1,8/1 :4,8/16; x:y:z= 0,6 : 1,8 : 0,3 = 2: 6 : 1 Значит простейшая формула соединения C2H6O и молярную массу 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O) = 2×12 + 6×1 + 16 = 24 + 6 + 16 = 46 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 23 = 46 г/моль Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(C2H6O) = 46 / 46 = 1 Значит формула органического соединения будет иметь вид C2H6O. |
| Ответ | C2H6O |
| Задание | Молярная масса соединения азота с водородом равна 32 г/моль. Определите молекулярную формулу вещества, массовая доля азота в котором составляет 85,7%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Вычислим массовую долю водорода в соединении: ω (H) = 100% — ω(N) = 100% — 85,7% = 14,3% Обозначим количество моль элементов, входящих в состав соединения за «х» (азот), «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = ω(N)/Ar(N) : ω(H)/Ar(H); x:y= 85,7/14 : 14,3/1; x:y= 6,12 : 14,3= 1 : 2 Значит простейшая формула соединения азота с водородом будет иметь вид NH2 и молярную массу 16 г/моль [M(NH2) = Ar(N) + 2×Ar(H) = 14+ 2×1 = 14 + 2 = 16 г/моль]. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(NH2) = 32 / 16 = 2 Значит индексы атомов азота и водорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид N2H4. Это гидразин. |
| Ответ | N2H4 |











