Химическая термодинамика
Определение и общие понятия химической термодинамики
Термодинамика является макроскопической теорией.
Химическая термодинамики использует термодинамические методы для решения задач химии, например, исследования теории разных видов химических и фазовых равновесий и свойств веществ в растворах.
Основной физической величиной, которая подлежит рассмотрению в термодинамике, является энергия. Основным законом термодинамики является вариация закона сохранения энергии. Спецификой макроскопических систем, рассматриваемых в термодинамике, является то, нельзя провести непосредственное измерение энергии макроскопической системы. Разные методы в физике дают возможность определить изменение энергии отдельных частиц системы (атомов, молекул, ионов). Не существует способов прямого измерения энергии как единого целого. Изменение энергии макросистемы определяют как теплоту или работу. Существование внутренней энергии макросистемы (![]() ), как физической величины было установлено в середине XIX века, после открытия первого начала термодинамики. Позднее появилась необходимость применять и другие, не измеряемые величины такие как: энтропия, энтальпия, химический потенциал и т.п. Каждая подобная величина определена как функция измеряемых величин, поэтому все выводы термодинамики можно проверить экспериментально.
), как физической величины было установлено в середине XIX века, после открытия первого начала термодинамики. Позднее появилась необходимость применять и другие, не измеряемые величины такие как: энтропия, энтальпия, химический потенциал и т.п. Каждая подобная величина определена как функция измеряемых величин, поэтому все выводы термодинамики можно проверить экспериментально.
Для описания свойств систем в термодинамике используют термодинамические переменные, которые называют термодинамическими параметрами. Термодинамические параметры — это физические величины, используя которые описывают явления, которые связаны с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул.
На основе первого начала термодинамики составляют уравнения теплового баланса. Второе и третье начала термодинамики служат для анализа фазового и химического равновесия.
Задачи химической термодинамики
Исследование законов химического и физического равновесия дают возможность решать следующие основные задачи:
- Определение условий реализации химических процессов. Вычисление тепловых эффектор химических реакций.
- Поиск пределов устойчивости исследуемых веществ при заданных условиях.
- Ликвидация (избегание) побочных реакций.
- Избрание оптимального режима проведения процесса.
Основные законы химической термодинамики
Первый закон термодинамики, которой отображает обмен энергией между системой и окружающей средой в форме работы и теплоты. Это одни из видов законов сохранения энергии. Формулировок первого начала термодинамики несколько, запишем один из них для закрытой системы:
![]()
где ![]() – количество теплоты, подведенное к системе;
– количество теплоты, подведенное к системе; ![]() – работа системы;
– работа системы; ![]() – изменение внутренней энергии системы.
– изменение внутренней энергии системы.
Энтальпией (![]() ) называют термодинамическую функцию, которая характеризует энергетическое состояние системы в изобарно — изотермических условиях ( то есть при
) называют термодинамическую функцию, которая характеризует энергетическое состояние системы в изобарно — изотермических условиях ( то есть при ![]() ). Энтальпия отражает тепловые изменения в системе, а теплота в окружающей среде. Количество теплоты, которое поглощается или выделяется в ходе химической реакции при
). Энтальпия отражает тепловые изменения в системе, а теплота в окружающей среде. Количество теплоты, которое поглощается или выделяется в ходе химической реакции при ![]() равно изменению энтальпии системы (энтальпия реакции).
равно изменению энтальпии системы (энтальпия реакции).
Закон Гесса для химических реакций говорит о том, что: величина теплового эффекта изобарных или изохорных процессов зависит только от начального и конечного состояний системы и не зависит от хода процесса.
Закон Гесса применяют для вычисления тепловых эффектов химических реакций.
Закон Гесса имеет полезные следствия:
- Энтальпия химической реакции при стандартных условиях равна разности алгебраической суммы энтальпий возникновения продуктов реакции, и суммы энтальпий образования исходных веществ.
- Теплота, которая выделяется при горении вещества в кислороде в количестве 1 моль до образования высших оксидов при стандартных условиях, называется стандартной теплотой сгорания вещества. Энтальпия реакции горения равна разности суммы энтальпий (с учетом знаков) сгорания исходных веществ и суммы энтальпий горения продуктов реакции при учете их стехиометрических коэффициентов. По закону Гесса количество выделяемой теплоты при окислении не зависит от того как и где происходит процесс горения, если продукты реакции не изменяются.
- При разложении вещества расходуется (требуется) такое же по модулю количество теплоты как при образовании данного вещества. Это закон Лавуазье – Лапласа.
- Если повести две реакции, которые приводят из разных начальных состояний к одним конечным состояниям, то разница в тепловых эффектах составит количество теплоты перехода из первого начального состояния во второе.
- При проведении двух реакций из одних начальных состояний в различные конечные состояния разница в тепловых эффектах составит тепловой эффект перехода от первого конечного состояния во второе.
Второй закон термодинамики говорит о направлении протекания процессов. Все самопроизвольные процессы происходят так, что система стремится к минимуму энергии, при этом энтропия системы увеличивается.
Примеры решения задач
| Задание | Каково затраченное количество теплоты в процессе, изображенном на рис.1? Процесс проводят с 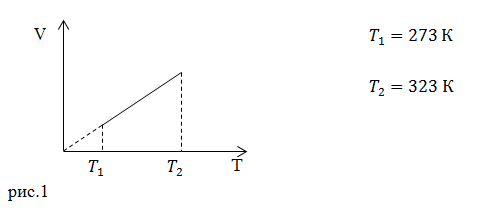
|
| Решение | Будем считать, что азот является идеальным газом. Тогда уравнение его состояния можно записать как уравнение Менделеева – Клапейрона:
где На рис. 1 изображен изобарический процесс. Для этого процесса запишем первое начало термодинамики в интегральном виде: где изменение внутренней энергии газа можно найти как: Работа при изобарном процессе в идеальном газе может быть найдена как: Из уравнения (1.1) и того, что Используя (1.2),(1.3) и (1.5) получаем: Для азота будем считать |
| Ответ |
| Задание | Вычислите изменение энтальпии ( |
| Решение | Отметим, что Из справочных материалов возьмем значения стандартных энтальпий образования веществ Используя следствие закона Гесса имеем: Химические реакции, которые проходят с выделением теплоты ( |
| Ответ |






![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV=}p\int^{V_2}_{V_1}{dV=p\left(V_2-V_1\right)} \qquad (1.4)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9d426329f78aaa6f2c497e793e8ecb7d_l3.png)





