Третий закон термодинамики
Первое и второе начала термодинамики ни чего не говорят о том, как ведет себя термодинамическая система около абсолютного нуля температур. Поэтому их дополняют третьим законом (началом), который еще называют по имени открывателя теоремой Нернста (теоремой Нернста — Планка). Данная теорема была получена эмпирически.
Современную формулировку данной теоремы дал М. Планк. Данный закон термодинамики описывает поведение термодинамической системы при низких температурах.
Формулировки третьего закона термодинамики
В состоянии равновесия энтропия всех тел устремляется к нулю при приближении температуры тела (T) к абсолютному нулю температур и это не зависит от того, какие значения принимают другие параметры, характеризующие состояние системы. В математическом виде третье начало термодинамики записывают как:
![]()
где S – энтропия. Это формулировка Планка.
Иначе третье начало термодинамики формулируют так: При температуре близкой к абсолютному нулю в любом изотермическом процессе изменение энтропии системы равно нулю, и это не зависит от изменения любых других параметров системы. Сформулированное Планком третье начало термодинамики находится в соответствии с тем, как определяют энтропию в статистической физике:
![]()
где k – постоянная Больцмана; w – термодинамическая вероятность. Получается, что при T=0 K термодинамическая система находится в основном квантовом состоянии (если состояние невырожденное), при этом w=1, что означает состояние системы, реализуется при помощи единственного микрораспределения. Если w=1, то S=0.
О выполнении теоремы Нернста судят по поведению вещества около абсолютного нуля температур. Теорема Нернста математически не доказывается, ее подтверждают эмпирически.
Для того чтобы получить объяснение третьего закона термодинамики прибегают к квантовой механике. Используя третье начало термодинамики можно найти абсолютную величину энтропии, а не ее изменение, как при помощи второго начала. Так как в соответствии с третьим началом термодинамики изменение энтропии при T=0 K устремляется к конечному пределу, который не зависит от равновесного состояния системы:
![]()
где x – произвольный термодинамический параметр системы. В формулировке Нернста третье начало звучит так:
Примеры решения задач
| Задание | Приведите следствия из третьего начала термодинамики. |
| Решение | Первым следствием из третьего закона термодинамики считают то, что теплоемкости любых тел (при постоянном давлении и постоянном объеме) становятся равными нулю при абсолютном нуле температур.
Вторым следствием из третьего начала термодинамики считают то, что при абсолютном нуле ( Третьим следствием можно назвать равенство нулю термодинамического коэффициента расширяемости. Следствием третьего закона термодинамики считают то, что невозможно провести такой процесс с конечным числом шагов, в котором тело охладится до абсолютного нуля температур. Это так называемый принцип недостижимости абсолютного нуля. К абсолютному нулю можно только приблизиться по асимптоте. |
| Задание | Для многих систем в термодинамике при температуре стремящейся к абсолютному нулю в обратимом процессе энтропия убывает по степенному закону:
где |
| Решение | За основу решения задачи примем выражение для теплоемкости, вида:
Для обратимого процесса элементарное изменение энтропии равно: Выразим из формулы (2.2) элемент количества теплоты: И подставим По условию задачи мы имеем выражение для изменения энтропии вида: Значитпри постоянном объеме: Подставим Тогда при |
| Ответ | 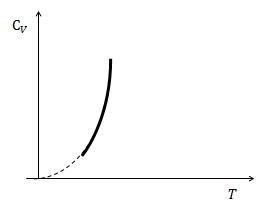
Рис. 1 |











