Термодинамика
Определение и основные понятия термодинамики
В отличие от молекулярно-кинетической теории, которая является второй составной частью молекулярной физики, термодинамика рассматривает макроскопические свойства тел и явлений, при этом не интересуется из молекулярным строением. Не смотря на то, что термодинамика не рассматривает поведение атомов и молекул, однако позволяет сделать выводы относительно течения микропроцессов.
Термодинамика считается количественной теорией тепловых процессов. Открытие закона сохранения энергии в XIX веке дало старт термодинамическим исследованиям. Термодинамика появилась для того, чтобы получить оптимальные условия использования теплоты при совершении работы. Этот раздел молекулярной физики появился и стал активно развиваться задолго до признания молекулярно-кинетической теории. Оказалось, что можно изучать многие свойства вещества, не рассматривая его строение.
Термодинамика является теорией тепловых явлений, которая не учитывает молекулярное строение вещества. Термодинамику называют описательной (феноменологической) теорией.
Термодинамика базируется на трех фундаментальных законах, которые называют началами термодинамики. Эти законы установлены, как обобщение большого числа эмпирических фактов. Выводы термодинамики имеют общий характер.
Задачи термодинамики
Задачей термодинамики является феноменологическое рассмотрение свойств веществ. При этом состояния этих веществ характеризуется макроскопическими параметрами. Как было сказано термодинамика основывается на трех началах.
Тепловые процессы – это процессы передачи и превращения энергии. Основные термодинамические законы отражают поведение энергии.
Моделью, на которой часто в термодинамике рассматривают термодинамические процессы, является модель идеального газа.
Основные законы термодинамики
Первое начало – это применение закона сохранения энергии к процессам, которые рассматривает термодинамика (тепловые явления). Закон сохранения энергии для теплоты, являющейся формой энергии (![]() ), внутренней энергии (
), внутренней энергии (![]() ) и работы (
) и работы (![]() ), которую совершает термодинамическая система в интегральном виде записывают:
), которую совершает термодинамическая система в интегральном виде записывают:
![]()
Это означает: Количество теплоты, подводимое к термодинамической системе, расходуется на совершение этой системой работы и изменение ее внутренней энергии. Условно считается, что если теплота к системе подводится, то она больше нуля (![]() ) и если работу выполняет сама термодинамическая система, то она положительна (
) и если работу выполняет сама термодинамическая система, то она положительна (![]() ).
).
В дифференциальном виде первое начало термодинамики имеет вид:
![]()
где ![]() – бесконечно малое количество теплоты, которое получает система;
– бесконечно малое количество теплоты, которое получает система; ![]() – элементарная работа, выполняемая системой;
– элементарная работа, выполняемая системой; ![]() – ее малое изменение внутренней энергии.
– ее малое изменение внутренней энергии.
Второе начало определяет направление развития процессов, исследуемых термодинамикой. Согласно данному началу теплота не может целиком превращаться в работу. Формулировок второго начала термодинамики несколько. Приведем одну из них:
В любом процессе, который происходит в замкнутой системе, энтропия не убывает. В виде формулы второй закон термодинамики можно представить как:
![Rendered by QuickLaTeX.com \[\int^{\left(1\right)}_{ \begin{array}{c} \left(2\right) \\ L \end{array} }{\frac{\delta Q}{T}=\int^{(1)}_{(2)}{dS}}=S_1-S_2\le 0 \qquad (3)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2d3a5972784cf01122d74ebfdfce4b3a_l3.png)
где ![]() – энтропия;
– энтропия; ![]() – путь, по которому система переходит из одного состояния в другое. Данная формулировка второго начала термодинамики базируется на определении энтропии как функции состояния термодинамической системы.
– путь, по которому система переходит из одного состояния в другое. Данная формулировка второго начала термодинамики базируется на определении энтропии как функции состояния термодинамической системы.
При помощи третьего начала накладываются ограничения на процессы, утверждается неосуществимость процессов, которые бы вели к достижению термодинамического нуля температуры.
Все термодинамические законы относятся к телам, количество молекул которых очень велико (макроскопические тела).
Примеры решения задач
| Задание | Запишите первое начало термодинамики в интегральном виде для идеального газа, если процесс, осуществляемый в газе а) изохорный; б) изотермический. |
| Решение | В качестве основы для решения задачи используем первое начало термодинамики в интегральном виде:
а) Рассмотрим изохорный процесс в идеальном газе. Для такого процесса: где Работа газа в изохорном процессе равна нулю, следовательно, первое начало термодинамики где изменение внутренней энергии идеального газа равно б) Рассмотрим изотермический процесс. Для такого процесса имеем: Изменения внутренней энергии в изотермическом процессе не происходит, следовательно, выражения (1.1) преобразуется к виду: Работу газа мы можем найти как: Для идеального газа в качестве уравнения состояния можно использовать уравнение Менделеева – Клапейрона: Из этого уравнения выразим давление и подставим его в (1.6), получим работу при изотермическом процессе в идеальном газе: Значит, первое начало термодинамики для изотермического процесса будет иметь вид: |
| Ответ | а) |
| Задание | На рис. 1 изображен цикл Карно в координатах 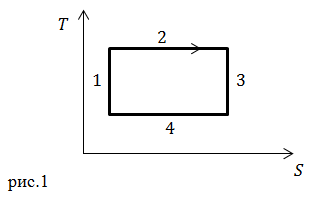
|
| Решение | Адиабатным называется термодинамический процесс, который осуществляется без теплообмена с окружающей средой. В таком процесс в идеальном газе, в котором осуществляют цикл Карно, энтропия газа остается постоянной. На графике рис.1 энтропия постоянна на отрезках 1 и 3. В адиабатном процессе газ совершает работу, то есть расширяется, за счет уменьшения внутренней энергии. Если внутренняя энергия уменьшается, следовательно, уменьшается температура газа. Получается, что при адиабатном расширении температура газа должна уменьшаться. Такому требованию из участков 1 и 3 соответствует отрезок 3. На участке 3 |
| Ответ | Адиабатное расширение происходит на участке 3 (рис.1). |






![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV\ } \qquad (1.6)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a4d72eea3efc40964bbc670372000ab5_l3.png)
![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{\frac{m}{\mu }R\frac{T}{V}dV=}\frac{m}{\mu }RT{\ln \left(\frac{V_2}{V_1}\right)} \qquad (1.8)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-94dba694aae337d7e477a0bbb99aded5_l3.png)





