Работа при адиабатическом процессе
Определение и общие сведения об адиабатических процессах
![]()
Уравнением адиабатического процесса в параметрах ![]() имеет вид:
имеет вид:
![]()
где ![]() – показатель адиабаты . Для идеального газа
– показатель адиабаты . Для идеального газа ![]()
К адиабатическим процессам можно отнести все термодинамические процессы, которые протекают с высокой скоростью.
Зная первое начало термодинамики в дифференциальном виде:
![]()
отталкиваясь от данного выше определения для адиабатного процесса первое начало термодинамики преобразуется к виду:
![]()
где ![]() – элементарное изменение внутренней энергии идеального газа.
– элементарное изменение внутренней энергии идеального газа.
Выражение (3) означает, что при адиабатическом процессе газ совершает работу за счет уменьшения своей внутренней энергии. В интегральном виде уравнение (4) запишем как:
![]()
Работа при адиабатическом процессе
Найдем выражение для вычисления работы, которую совершает идеальный газ в адиабатном процессе. За основу примем уравнение (3) в виде:
![]()
Если газ расширяется от объема ![]() до объема
до объема ![]() , то его температура уменьшается от
, то его температура уменьшается от ![]() до
до ![]() . Проведем интегрирование выражения (6), получим:
. Проведем интегрирование выражения (6), получим:
![Rendered by QuickLaTeX.com \[A=-\frac{i}{2}\nu R\int^{T_2}_{T_1}{dT=}\frac{i}{2}\nu R\left(T_1-T_2\right) \qquad (7)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0d16fd83d40635bfce7db167ea34addf_l3.png)
Для перехода в выражении (7) в правой части к другим параметрам состояний газа используют уравнение процесса в виде:
![]()
Подставим вместо ![]() правую часть (8) в формулу (7), имеем:
правую часть (8) в формулу (7), имеем:
![]()
Или если использовать уравнение Менделеева — Клапейрона для первого состояния газа:
![]()
То выражение (9) перепишем как:
![]()
где ![]()
Работа, которую совершает газ при адиабатическом расширении меньше, чем, например, при изотермическом, при тех же начальной и конечной температурах. Это происходит из-за того, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом процессе температуру поддерживают, подводя к термодинамической системе теплоту. Вследствие этого, в изотермическом процессе при увеличении объема газа давление газа уменьшается только за счет уменьшения плотности вещества. Тогда как при адиабатном расширении давление газа уменьшается за счет уменьшения плотности газа и средней кинетической энергии, то есть температуры.
Примеры решения задач
| Задание | Идеальный газ (число степеней свободы молекулы |
| Решение | Первое начало термодинамики для адиабатического процесса запишем как:
В качестве основы для решения задачи удобно использовать формулу для вычисления работы в виде: где Выразим массу газа из формулы (1.2), получим: Учитывая равенство (1.1), масса равна: |
| Ответ |
| Задание | Каково отношение работ (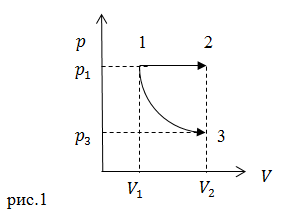
|
| Решение | На рис.1 представлены два процесса. Процесс 1-2 изобарный ( Работу в адиабатном процессе в нашем случае удобнее найти как: Найдем отношение |
| Ответ |






![Rendered by QuickLaTeX.com \[m=\frac{A\left(\gamma -1\right)\mu }{RT_1(1-{\left(\frac{1}{n}\right)}^{\gamma -1})} \qquad (1.3)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-196ff4df5de750df0d0f65ba8ec4ed01_l3.png)
![Rendered by QuickLaTeX.com \[m=\frac{-\Delta U\left(\gamma -1\right)\mu }{RT_1(1-{\left(\frac{1}{n}\right)}^{\gamma -1})}\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4e9eae3705468a75b3ec96e12724dda6_l3.png)





