Энтропия в термодинамике
Понятие энтропии в термодинамике
Понятие энтропии ввел в XIX веке Р. Клаузиус. Энтропия (![]() ) – это функция состояния, в обратимом процессе дифференциалом которой является величина
) – это функция состояния, в обратимом процессе дифференциалом которой является величина ![]() :
:
![]()
где ![]() – количество теплоты, полученное термодинамической системой в ходе обратимого процесса;
– количество теплоты, полученное термодинамической системой в ходе обратимого процесса; ![]() – термодинамическая температура системы.
– термодинамическая температура системы.
В любом обратимом круговом процессе изменение энтропии равно нулю:
![]()
Энтропия системы, которая совершает необратимый цикл, растет:
![]()
Выражения (2) и (3) относятся только к замкнутым системам, в том случае, если система обменивается теплотой с внешней средой, то энтропия может вести себя как угодно. Формулы (2) и (3) в единстве представляют собой неравенство Клаузиуса:
![]()
которое говорит о том, что в замкнутых системах при обратимых процессах, энтропия остается постоянной, а в необратимых процессах она растет.
В случае равновесного перехода из одного состояния в другое, в соответствии с определением энтропии (1), имеем:
![]()
где ![]() по первому началу термодинамики.
по первому началу термодинамики. ![]() – изменение внутренней энергии термодинамической системы;
– изменение внутренней энергии термодинамической системы; ![]() – работа выполняемая системой. В формуле (5) подынтегральное выражение и пределы интегрирования следует выразить, используя параметры, которые характеризуют процесс, происходящий в термодинамической системе. Выражение (5) определяет энтропию с точностью до аддитивной постоянной. Физический смысл несет изменение энтропии, а не сама энтропия.
– работа выполняемая системой. В формуле (5) подынтегральное выражение и пределы интегрирования следует выразить, используя параметры, которые характеризуют процесс, происходящий в термодинамической системе. Выражение (5) определяет энтропию с точностью до аддитивной постоянной. Физический смысл несет изменение энтропии, а не сама энтропия.
Свойство энтропии
Энтропия имеет свойство аддитивности: Энтропия совокупности тел равна сумме энтропий каждого тела, которое входит в систему.
Глубинный смысл энтропии открывает статистическая физика. Больцман установил, что энтропия системы связана с термодинамической вероятностью (![]() ):
):
![]()
где ![]() – постоянная Больцмана.
– постоянная Больцмана.
Напомним, что термодинамической вероятностью называют число способов, при помощи которых можно реализовать макросостояние термодинамической системы, или количество микросостояний, которые реализуют данное макросостояние.
В соответствии с (6) энтропия — это мера вероятности состояния термодинамической системы. Иногда, исходя из статистического толкования энтропии, говорят, что энтропия – мера неупорядоченности системы.
Примеры решения задач
| Задание | Найдите изменение энтропии в процессах идеального газа. |
| Решение | В качестве основы для решения задачи используем формулу:
Для идеального газа изменение внутренней энергии: Работа газа по определению равна: Или, если учесть, что из уравнения Менделеева – Клайперона: получаем, что элементарная работа идеального газа равна: Подставим выражения (1.2) и (1.5) в определение изменения энтропии (1.1), получим: Изменение энтропии при переходе из одного состояния в другое для идеального газа не зависит от процесса перехода. |
| Ответ |
| Задание | Идеальный газ (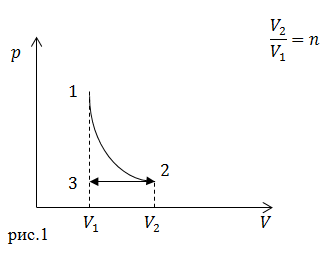
|
| Решение | Так как энтропия является функцией состояния, то ее изменение в процессах перехода от точки 1-2-3 можно заменить на изменение энтропии в переходе 1-3. То есть:
В качестве основы для решения задачи воспользуемся формулой, которую мы получили в примере 1: Для изохорного процесса выражение (2.2) принимает вид: Так как процесс 3-1 изохорный, то для него справедлив закон Шарля: Воспользуемся уравнением адиабаты для процесса 1-2, и учтем, что процесс 2-3 изобарный, запишем: Подставим правую часть выражения (2.5) вместо отношения |
| Ответ |











